രാസബന്ധനം പാർട്ട് 3
• സഹസംയോജകബന്ധനം :
ഇലക്ട്രോൺ പങ്കുവയ്ക്കൽ മൂലമുണ്ടാകുന്ന രാസബന്ധനത്തെ സഹസംയോജക ബന്ധനം എന്നു പറയുന്നു.
•ഏകബന്ധനം :
സഹസംയോജക ബന്ധനത്തിൽ ഒരുജോഡി ഇലെക്ട്രോണുകളുടെ പങ്കുവയ്ക്കൽ മൂലമുണ്ടാകുന്ന രാസബന്ധനത്തെ ഏകബന്ധനം എന്നു പറയുന്നു.
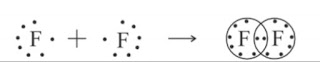
ഉദാ : ഫ്ലൂറിൻ തന്മാത്ര F2
F-F
ദ്വഇബന്ധനം :
രണ്ടു ജോഡി ഇലെക്ട്രോണുകളുടെ പങ്ക്യ്ക്കൽ മൂലമുണ്ടാകുന്ന സഹസംയോജക ബന്ധനത്തെ ദിബന്ധനം എന്നു പറയുന്നു.
ഉദാ : ഒക്സിജൻ തന്മാത്ര
• ത്രീബന്ധനം :
മൂന്ന്ജോഡി ഇലെക്ട്രോണുകളുടെ പങ്കുവയ്ക്കൽ മൂലമുണ്ടാകുന്ന സഹസംയോജകബന്ധനത്തെ ത്രീബന്ധനം എന്നറിയപ്പെടുന്നു.
ഉദാ : നൈട്രജൻ തന്മാത്ര
• സഹസംയോജക സംയുക്തങ്ങൾ :
സഹസംയോജക ബന്ധനം വഴിയുണ്ടാകുന്ന സംയുക്തങ്ങളെ സഹസംയോജക സംയുക്തങ്ങൾ എന്നറിയപ്പെടുന്നു.
അലോഹമൂലകങ്ങൾ തമ്മിൽ സംയോജിക്കുമ്പോൾ സാധാരണയായി സഹസംയോജകസംയുക്തങ്ങളാണ് ഉണ്ടാകുന്നത്.
• ഹൈഡ്രജൻ ക്ലോറൈഡ് HCl
•പങ്ക് വയ്ക്കുന്ന ഇലക്ട്രോൺ ജോഡികളുടെ എണ്ണമെത്ര?
ഒരു ജോഡിഇലെക്ട്രോണുകൾ
• പ്രതീകങ്ങൾ ഉപയോഗിച്ച് ബന്ധനം ചിത്രീകരിക്കുക. H-Cl
•കാർബൺ ടെട്രക്ലോറൈഡ് CCl4
i)കാർബൺ ആറ്റത്തിന് അഷ്ടകം പൂർത്തിയാക്കാൻ എത്ര ഇലക്ട്രോൺ വേണം? 4 ഇലെക്ട്രോണുകൾ
ii)ക്ലോറിൻ ആറ്റത്തിന് അഷ്ടകം പൂർത്തിയാക്കാൻ എത്ര ഇലക്ട്രോൺ വേണം? ഒരു ഇലക്ട്രോൺ
iii)കാർബണിന് അഷ്ടകം പൂർത്തിയാക്കാൻ എത്ര ക്ലോറിൻആറ്റവുമായി സയോജിക്കണം? 4
iv) കാർബൺ ടെട്രാക്ലോറൈഡ് തന്മാത്രയിൽ ഏതുതരം രാസബന്ധനത്തിനാണ് സാധ്യത?
സഹസംയോജക ബന്ധനം
v)കാർബൺ ആറ്റം ഓരോ ക്ലോറിൻ ആറ്റവുമായി എത്ര ജോഡി ഇലെക്ട്രോണുകളെ പങ്ക് വയ്ക്കുന്നു ?
ഒരു ജോഡി ഇലക്ട്രോൺ
vi)കാർബൺ ആറ്റം എല്ലാ ക്ലോറിൻ ആറ്റങ്ങളുമായി ആകെ എത്ര ജോഡി ഇലെക്ട്രോണുകളെ പങ്ക് വയ്ക്കുന്നു ?
4 ജോഡി ഇലെക്ട്രോണുകൾ
vii)പ്രതീകം ഉപയോഗിച്ച് തന്മാത്രയെ എങ്ങനെ സൂചിപ്പിക്കാം.
• ഇലക്ട്രോനെഗറ്റിവിറ്റി :
സഹസംയോജകബന്ധനത്തിൽ ബന്ധനത്തിൽ ഏർപ്പെട്ട രണ്ടാറ്റങ്ങൾക്കിടയിൽ പങ്ക്വച്ച ഇലക്ട്രോൺ ജോഡികളെ ആകർഷിക്കാനുള്ള അതത് ആറ്റത്തിന്റെ കഴിവാണ് ഇലക്ട്രോനെഗറ്റീവിറ്റി.
മൂലകങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവിറ്റി താരതമ്യം ചെയ്യുന്നതിനായി ലീനസ്പോളിംങ് ആവിഷ്കരിച്ച സ്കയിൽ ആണ് പോളിങ് സ്കയിൽ.ഇതൊരു ആപേക്ഷിക സ്കയിലാണ്. പൂജ്യത്തിനും നാലിനുമിടയിലുള്ള സംഖ്യകളാണ് മൂലകങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവിറ്റി വിലയായി നൽകിയിട്ടുള്ളത്. ഈ സ്കയിലിൽ ഇലക്ട്രോനെഗറ്റിവിറ്റി ഏറ്റവും കൂടിയ മൂലകം ഫ്ലൂറിൻ (F) ആണ്.
*ഒരു സംയുക്തത്തിലെ ഘടക മൂലകങ്ങളുട ഇലക്ട്രോനെഗറ്റിവിറ്റി വിലകൾ തമ്മിലുള്ള വ്യത്യാസം 1.7 ഓ അതിൽ കൂടുതലോ ആണെങ്കിൽ പൊതുവെ അയോണിക സ്വഭാവവും 1.7 ൽ കുറവാണെങ്കിൽ സഹസംയോജക സ്വഭാവവും ആയിരിക്കും ഉണ്ടാവുക.
•പോളാർ സ്വഭാവം :i)ഇലക്ട്രോ നെഗറ്റിവിറ്റി കുറഞ്ഞ മൂലകത്തിന്റെ പ്രതീകം ആദ്യം എഴുതുക.











0 അഭിപ്രായങ്ങള്:
ഒരു അഭിപ്രായം പോസ്റ്റ് ചെയ്യൂ
ഇതിനായി സബ്സ്ക്രൈബ് ചെയ്ത പോസ്റ്റിന്റെ അഭിപ്രായങ്ങള് [Atom]
<< ഹോം